- Produkte /
- Life Science /
- Discover Enzymatischer Verdau /
- Überblick
Labormikrowelle Discover für enzymatische Aufschlüsse und Hydrolysen
Mikrowellenunterstützter Enzymatischer Aufschluss
Der enzymatische Aufschluss ist ein wichtiger Schritt in der Probenvorbereitung zur Sequenzanalyse von Proteinen. Dieser Arbeitsschritt beinhaltet das selektive enzymunterstützte Zersetzen von Proteinen in kleinere Peptide nach bestimmten Aminosäurebindungen. Hierbei kommt dem Enzym Trypsin eine wichtige Bedeutung zu, da es die Aminosäurekette nach Lysin und Arginin aufspaltet. Komplexe Software-Programme analysieren diese Peptidfragmente und geben dadurch Auskunft über die ursprünglichen Aminosäuresequenzen des Proteins. Die Präzision und Aussagekraft dieser Softwareergebnisse hängt somit wesentlich von der Effizienz des Trypsin-Aufschlusses und den dadurch enthaltenen Peptidfragmenten ab.
Der klassische enzymatische Aufschluss wird typischerweise bei 37 °C Aufschlusstemperatur durchgeführt und dauert von 8 bis 24 Stunden. Sehr häufig ist der Aufschluss nicht komplett und somit kann nicht das gesamte Protein identifiziert werden. Speziell die hydrophoben Proteine lassen sich vom Trypsin nur unzureichend aufspalten.
Dieser hohen Zeitintensität steht der Bedarf an einem hohen Probendurchsatz gegenüber. Deshalb werden Trypsin-Aufschlüsse häufig in 96 Well Platten durchgeführt. Mit der Mikrowelle werden die Trypsin-Aufschlüsse enorm beschleunigt und die Aufschlussqualität wird wesentlich verbessert. Allerdings ist der Einsatz von 96 Well Platten in Mikrowellen-Laborgeräten ein schwieriges Unterfangen, da die einzelnen Positionen auf der 96 Well Platte in Multi-Mode Mikrowellengeräten sehr unterschiedlich die Mikrowelle einkoppeln. Unterschiedliche Lösungsansätze mit Mikrowellenabsorbern wie z.B. graphitdotiertem Teflon oder SiC Keramik führten in der Praxis ebenfalls nicht zu befriedigenden Lösungen, um die unterschiedliche Temperaturentwicklung in den einzelnen Positionen zu regulieren.
In Mono-Mode-Mikrowellensystemen ist aufgrund der gleichmäßigen Mikrowellenverteilung ein gleichmäßiges Einkoppeln in nebeneinander angeordnete Positionen zu beobachten, allerdings passen die 96 Well Platten nicht in eine Mono-Mode-Mikrowellenkammer. Für das Mono-Mode Mikrowellengerät Discover wurde somit ein spezieller Probenhalter entwickelt, damit Eppendorf Gefäße im Discover eingesetzt werden können und gleichmäßig Mikrowelle adsorbieren.
Vorteile des enzymatischen Aufschlusses in der Discover Mikrowelle
- Höhere Aufschlussqualität, speziell bei hydrophoben Proteinen
- Schneller Aufschluss in 10 min. im Vergleich zur klassischen Arbeitsweise mit Zeiten von vielen Stunden
- Hoher Durchsatz: Aufschluss von 14 Proben alle 10 min.
- Einsatz von Standard 1,5 ml Eppendorf Gefäßen mit Verschlusskappe
- Aufschluss in Lösung oder in Gel möglich

Warum wirkt die Mikrowelle auf den enzymatischen Aufschluss?
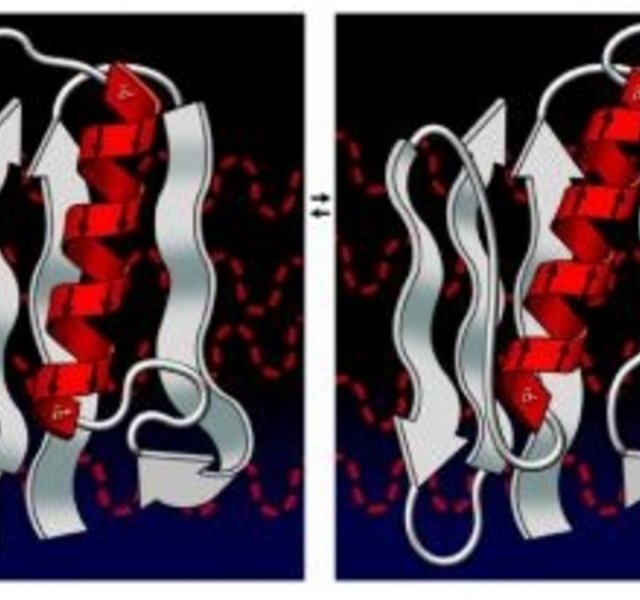
Jede Peptid-Bindung verfügt über ein starkes Dipolmoment, welche von der Mikrowellenstrahlung gezielt aktiviert wird. In der Peptid-Synthese wird diese molekulare Eigenschaft genutzt, um schwierige Sequenzen und lange Aminosäureketten darzustellen, die klassisch kaum möglich sind. Man nimmt in theoretischen Modellen an, das die Kettenaggregation infolge von Mikrowelleneinwirkung abnimmt und die Aminosäureketten gestreckt werden, also für die Addition weiterer Aminosäuren zugänglich werden.
Dasselbe Prinzip der Streckung der Aminosäuren macht man sich beim enzymatischen Aufschluss zu Nutzen. Die Bindungen zwischen den einzelnen Aminosäuren werden für den Angriff des Trypsins zugänglich. Für die Wirkungsweise der Proteine ist ihre räumliche Struktur (ihre Faltung) besonders wichtig. Die Proteinstruktur lässt sich auf vier Betrachtungsebenen beschreiben: Die Primärstruktur, die Sekundärstruktur, die Tertiärstruktur sowie die Quartärstruktur. Für die Betrachtung des Einflusses der Mikrowelle ist speziell die Sekundärstruktur von Interesse. Als Sekundärstruktur wird die räumliche Anordnung der Aminosäuren eines Proteins bezeichnet. Man unterscheidet dabei zwischen folgenden Strukturtypen: Alpha-Helix, Beta-Faltblatt, Beta-Turn und ungeordnete, so genannte Random-Coil-Strukturen. Diese Strukturen ergeben sich durch Wasserstoffbrückenbindungen zwischen den Peptidbindungen des Polypeptid-Rückgrates. Die Helixstruktur stellt eine Spiralisierung des Proteins dar, ähnlich dem Aufbau der Doppelstrang DNA. Diese Spirale maximiert die einzelnen Dipole der Aminosäurebindungen zu einem großen Dipolmoment über die gesamte Helixstruktur, was wiederum zu großen Wechselwirkungen mit dem oszilierenden Mikrowellenfeld führt.
Applikation
Informationen
Anfragen
Kontakt
Carl-Friedrich-Gauß-Straße 9
D-47475 Kamp-Lintfort
+49 (0) 2842 96440
+49 (0) 2842 964422